ライフテクノロジーズジャパン株式会社 バイオサイエンス事業部
- HOME
- ライフテクノロジーズジャパン株式会社 バイオサイエンス事業部
- 製品・サービス詳細
- 核酸抽出効率の比較 KingFisher Duo Primeシステムを用いた磁気ビーズ抽出法とスピンカラム抽出法の比較
会社カテゴリー:研究関連資材
主サービス提供地域:
製品・サービス詳細
核酸抽出効率の比較
KingFisher Duo Primeシステムを用いた磁気ビーズ抽出法とスピンカラム抽出法の比較
高いプロセス効率と最適なサンプル抽出の達成
概要
• Thermo Scientific™ KingFisher™ Duo Prime核酸・タンパク質・細胞自動抽出・精製装置を用いた磁気ビーズ抽出法は、スピンカラム法よりもマニュアルによる作業時間が短縮されます。
• KingFisher Duo Primeシステムを用いると、サンプル量が少なくても優れた核酸抽出(同様の DNA 収量、より高品質のRNA)を実現します。
• Applied Biosystems ™ MagMAX™核酸抽出キットは、多種多様なサンプルに対応したハイスループット処理が可能です。
はじめに
生体試料の分子生物学的解析では核酸抽出が日常的に行われますが、核酸の正確な定量には精製手法が大きく左右します。核酸の抽出には、スピンカラムを用いた固相抽出法や磁気ビーズ抽出法がよく使われます。Thermo Scientific™ KingFisher™システムを用いた磁気ビーズ抽出法は、多種多様なサンプルタイプからの DNAやRNA の分離に、ハイスループットの半自動化ソリューションをもたらします。磁気ビーズ抽出キットとKingFisher Duo Primeシステムを併用すると、さまざまなサンプルタイプに対する小スケールの半自動化ワークフローが実現するのみならず、マニュアルによる作業時間も最小限で済みます。本資料では、KingFisher Duo Primeシステムが安定した収量と品質の得られる核酸抽出法であることを、スピンカラム抽出法と比較しながら紹介していきたいと思います。
材料・方法
サンプル調製と核酸の品質
2名のドナーから全血検体を採取し、凍結血液からDNAを、新鮮な全血サンプルからRNAを抽出しました。また、接着性の肺がん細胞株 3 種をATCC から購入し、NCI-H1650(ATCC、製品番号:CRL-5883)とNCI-H1781(ATCC、製品番号:CRL5894)をDNA抽出に、NCI-H23(ATCC、製品番号:CRL-5800)とNCI-H1781をRNA抽出に使用しました。組織サンプルからの核酸抽出にはウサギの肝臓と心臓を使用しました。磁気ビーズを用いたDNA 抽出にはApplied Biosystems™ MagMAX™ DNA Multi-Sample Ultra 2.0 KitとKingFisher Duo Primeシステム(各サンプルタイプに応じたDNA抽出プロトコル)を用い、磁気ビーズを用いたトータルRNA(スモールRNAを含める)の抽出には、Applied Biosystems™ MagMAX™ mirVana™ Total RNA Isolation Kitを用いました。スピンカラムによるRNAとDNAの抽出には、サンプルタイプに適したキット(A社キット、B社キット)を提供される取扱説明書どおりに使用しました。
インプットしたサンプル量は、全血からの DNA および RNA 抽出には50 µLおよび100 µL、細胞からのDNAおよびRNA抽出には10,000および100,000細胞、ウサギの肝臓および心臓組織からのDNAおよびRNA抽出には2.5 mgおよび10 mgとしました。抽出したDNAの収量、品質、純度(A260/A280およびA260/A230)を、Thermo Scientific™ NanoDrop™ 8000マルチチャンネル超微量紫外可視分光光度計で分析しました。また、RNAの収量をNanoDrop 8000マルチチャンネル超微量紫外可視分光光度計で、品質をAgilent™ 2100バイオアナライザで分析しました。また、RT-qPCRアッセイによるダウンストリームの遺伝子発現解析ならびにgDNAコンタミネーションレベルの検出からも、RNAの品質を確認しました。
RT-qPCRを用いた遺伝子発現解析
遺伝子発現レベルを、Applied Biosystems™ QuantStudio™ 5リアルタイムPCRシステム(384ウェルブロック、高速サイクル条件)を用いた 1 ステップ RT-qPCR で評価しました。具体的には、20 µL の PCR 反応あたり、細胞または血液サンプルから精製した核酸2 µL、心臓組織(10倍希釈)から精製した核酸2 µLもしくは肝臓組織(100倍希釈)から精製した核酸2 µL
を、5 µLのApplied Biosystems™ TaqMan™ Fast Virus 1-Step Master Mixと1 µLのApplied Biosystems™ TaqMan™ Gene Expression Assayプライマー&プローブセット(20X)を含有する反応ミックスに添加して反応液を調製しました。反応条件の設定は、50 ˚C、5分間の逆転写(RT)反応を1サイクル、95 ˚C、20秒間の逆転写酵素不活化と初回熱変性を1サイクル、95 ˚Cで3秒間の反応活性化と60 ˚Cで30秒間の増幅を40サイクルとしました。qPCR 反応は2 回ずつ行い、自動設定で決定した閾値とベースラインを用いてデータ解析を行いました。
RNAサンプル中のゲノムDNA評価
RNAサンプル中のゲノムDNA(gDNA)コンタミネーションを、Invitrogen™ SuperScript™ IV VILO™ Master Mixを用いて評価しました。SuperScript IV VILOキットには逆転写酵素を含有する+RTマスターミックスと逆転写酵素を含有しない-RTマスターミックスが含まれており、RNAサンプル中のgDNAを検出できます。おのおのの RNA サンプルに対して+RTマスターミックスを加えた逆転写反応と-RTマスターミックスを加えた逆転写反応(ネガティブコントロール)を行った後、これらをさらにエクソンをターゲットとするqPCRアッセイにかけてRNAとgDNAを検出しました。具体的には、逆転写反応を済ませた +RT 反応液および-RT反応液2 µLを、5 µLのApplied Biosystems™ TaqMan™ Fast Advanced Master Mix for qPCRと1 µL のTaqMan Gene Expression Assayプライマー&プローブセット(20X)を含有する反応ミックスに添加して反応液20 µLを調製しました。反応条件の設定は、50 ˚C、2 分間を1サイクル、95˚C、20秒間を1サイクル、95 ˚Cで1秒間の反応活性化と60 ˚Cで20秒間の増幅を40サイクルとしました。
結果
MagMAX DNA Multi-Sample Ultra 2.0 KitとKingFisher Duo Primeシステムを用いたDNAの抽出
3種の異なるサンプルタイプ全てを総合的に判断すると、磁気ビーズ抽出法は、スピンカラム法に代わる効率的かつ自動化の容易なDNA抽出法であるといえます(図1)。ただし、サンプルタイプによって違いが認められ、例えば、細胞からのDNA収量は、磁気ビーズ法とA 社のスピンカラム抽出キットでは同程度でしたが、B社キットはどの細胞インプット数に対しても高い収量が得られました。また、ウサギの心臓および肝臓組織からの抽出では、磁気ビーズ法の方が両社のスピンカラム抽出キットよりも高い収量が得られ、全血サンプルからのDNA分離では、いずれのキットも同様の抽出能を示しました。抽出DNAの純度(A260/A280、A260/A230)は、抽出法やサンプルタイプにかかわらずおおむね同程度でした。
MagMAX mirVana Total RNA Isolation KitとKingFisher Duo Primeシステムを用いたRNAの抽出
MagMAX mirVanaキットを用いた磁気ビーズ法で抽出できたRNA収量は、組織および全血サンプルではスピンカラム法よりも高く、細胞サンプルでは同程度でした(図3)。抽出RNAの純度をAgilent 2100バイオアナライザによる電気泳動で評価したところ、抽出手法によってRNAの品質に大きな差が認められました。まず、MagMAX mirVanaキットは、スピンカラム法よりも高品質の RNAおよびスモール RNAを分離できました(図 4)。いずれの手法も質の高いRNAを抽出できましたが、スピンカラム法(特にB社のスピンカラムキット)では細胞および全血サンプルの電気泳動図に複数の追加ピークが出現しており、gDNAコンタミネーションが示唆されました(図4)。
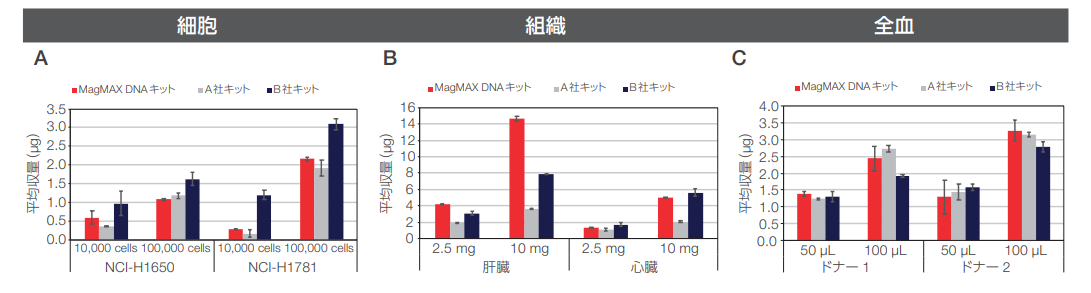
図1.MagMAX DNA Multi-Sample Ultra 2.0 KitとKingFisher Duo Primeシステムを用いた抽出法による(A)細胞、(B)組織、(C)全血からのDNA収量

図2.細胞、組織、全血からの抽出DNAの純度
MagMAX DNA Multi-Sample Ultra 2.0 KitとKingFisher Duo Primeシステムを用いて、(A)細胞、(B)組織、(C)全血から精製したDNAのA260/A280値とA260/A230値を算出しました。

図3.MagMAX mirVana Total RNA Isolation KitとKingFisher Duo Primeシステムを用いた抽出法によるRNA収量
(A)細胞からのRNA収量はいずれも同程度でしたが、(B)組織や(C)全血からは磁気ビーズ法の方がスピンカラム法より高い収量が得られました。
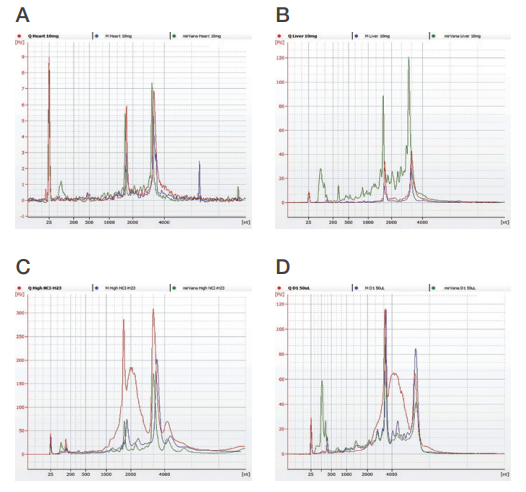
図 4.Agilent 2100バイオアナライザを用いて解析した細胞、組織、全血からの RNA の品質
(A)心臓組織と(B)肝臓組織から抽出したトータルRNA(スモールRNAを含める)の品質は、MagMAX mirVanaTotal RNA Isolation Kitを用いた方がスピンカラムよりも高品質でした。また、MagMAX mirVanaキットは、(C)gDNAコンタミネーションのない細胞内RNA、および(D)少量の全血サンプルからのRNAを抽出できました。
全血サンプルからの抽出 RNAを用いてダウンストリームの遺伝子発現解析を行い、ハウスキーピング遺伝子であるACTBとADH5 の増幅サイクル数(Ct)を調べたところ、Ct値に有意な差は認められませんでした(図5A)。一方、gDNAコンタミネーションの解析では、B社のスピンカラムを用いて抽出したRNAにはgDNAコンタミネーションがみられ、低い Ct値を示しました。MagMAX mirVanaキットやA社のスピンカラムによる抽出RNAにgDNAコンタミネーションは認められませんでした(図5B)。この結果を裏付けるように、Agilent 2100バイオアナライザによる電気泳動図にもgDNAの混在を示す追加波形が出現していました。
細胞サンプルからの抽出 RNA の ACTB および ADH5 遺伝子発現レベルはいずれの手法も類似しており、同様のCt値でした(図6A)。ただし、MagMAX mirVanaキットによる抽出RNAは、Ct値が最も高かったことからみてとれるように、gDNAコンタミネーションが最小でした(図6B)。組織サンプルについては、ACTBおよびADH5に対するCt値はMagMAX mirVanaキット抽出RNAの方が低く、高収量が示唆されました(図7)。
スピンカラム法と磁気ビーズ法はダウンストリームの遺伝子発現解析での使用に必要なRNAを効率的に抽出しており、評価した各種キットにとってRNA収量は制約要因とはならないことが示唆されました。一方で、品質に関しては各キットによる抽出RNA間でばらつきがあり、ダウンストリームアプリケーションに影響する可能性を完全には否定できません。
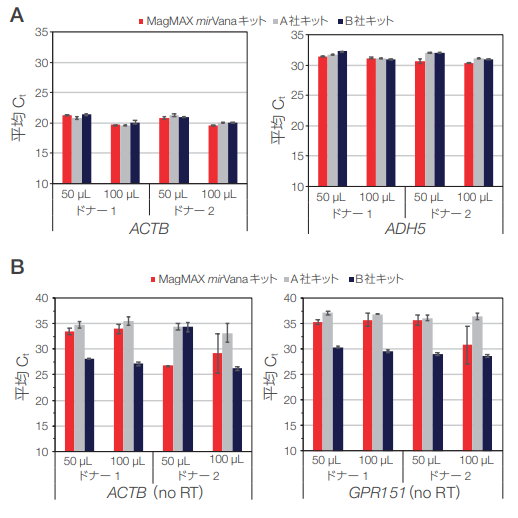
図5.血液サンプルから精製したRNAの遺伝子発現とgDNAコンタミネーションの解析
(A)血液検体から分離したRNA の遺伝子発現レベルは、3種いずれのキットも同様の結果が得られました。(B)gDNAコンタミネーション解析によると、B 社のスピンカラムで分離したRNA のCt値が最も低く、gDNAコンタミネーションが多いことが示唆されました。

図6.細胞サンプルから精製したRNAの遺伝子発現とgDNAコンタミネーションの解析
(A)細胞から分離したRNAの遺伝子発現レベルは、3 種いずれのキットも同様の結果が得られました。(B)gDNAコンタミネーション解析によると、B社のスピンカラムを用いて分離したRNAのCt値が最も低く、gDNAコンタミネーションが多いことが示唆されました。
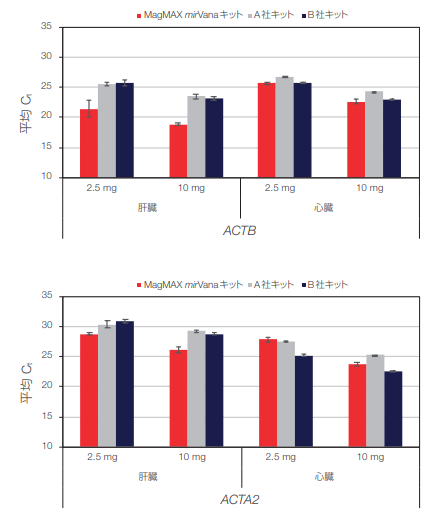
図 7.肝臓および心臓組織サンプルから精製したRNA の遺伝子発現解析
MagMAX mirVanaキットで分離したRNAのCt値は低く、スピンカラムより収量が高いことが示唆されました
結論
現在市販されているDNAおよびRNAのスピンカラム抽出法と磁気ビーズ抽出法のワークフローやマニュアルによる作業時間には、実用に影響し得る差が存在します。MagMAX DNA MultiSample Ultra 2.0 Kitを用いたDNA抽出法をスピンカラム法と比較評価したところ、前者の磁気ビーズ法は収量および品質ともにダウンストリームアプリケーションに適した優れたDNAを精製できました。またRNA の抽出については、磁気ビーズ法もスピンカラム法も増幅可能な RNA 収量が得られましたが、MagMAX mirVana Total RNA Isolation KitはさらにgDNAコンタミネーションのない高品質の RNAを精製できました。今回の比較評価で示されたように、スケーラブルかつ自動化可能なKingFisher Duo Primeシステムを用いた磁気ビーズワークフローは、多種多様なサンプルタイプに対応でき、柔軟性があり、かつ時間の節約も可能な核酸抽出法を実現します。
Ordering information