ライフテクノロジーズジャパン株式会社 バイオサイエンス事業部
- HOME
- ライフテクノロジーズジャパン株式会社 バイオサイエンス事業部
- 製品・サービス詳細
- 空間生物学における標識抗体とEVOS S1000 Spatial Imaging Systemを用いた結腸腺がんのがん微小環境研究
会社カテゴリー:研究関連資材
主サービス提供地域:
製品・サービス詳細
空間生物学における標識抗体とEVOS S1000 Spatial Imaging Systemを用いた結腸腺がんのがん微小環境研究
サービスカテゴリー:分析、検査
空間生物学における標識抗体とEVOS S1000 Spatial Imaging Systemを用いた結腸腺がんのがん微小環境研究
はじめに
結腸がん(CRC)は世界のがん死亡原因の第2位であり、罹 患率は若年成人の間で増加傾向にあるため、研究の優先順位が高くなっています。CRC研究における重要な課題は腫瘍の不均一性です[1] 。結腸がんは、患者間変動が大きく、腫瘍内不均一性が高いという特徴があります。これは、異なる変異状態や微小環境が同一腫瘍内の異なる場所に存在するためです。このような複雑性により、的確な治療法の開発や患者の治療効果の予測が困難となるため、CRCの腫瘍の特異的な分子的・構造的特徴をより深く理解する必要があります。
空間生物学は、マルチプレックスのイメージング解析を行うことで組織の微小環境の生理学的文脈における分子特性の把握を可能にし、病理学やがん研究に変革をもたらしつつあります。このような研究は、従来のシングルセル解析では見逃されがちであった、生物学的プロセスが細胞環境によってどのような影響を受けるかについての洞察を提供します。例えば、ヒトの腫瘍には免疫細胞が浸潤していることが多く、研究者たちは、患者の転帰と腫瘍内の特定の免疫細胞集団の密度および腫瘍周囲の浸潤縁との間に相関関係があることを同定しています[2,3]。これらの免疫細胞サブタイプは、免疫組織化学的組織染色( IHC)によって検出できる特定のバイオマーカーまたはバイオマーカーの組み合わせを発現しています。マルチプレックスイメージングと互換性のある蛍光イメージング装置は、このアプローチの中心を担っており、ヒトの腫瘍組織におけるがん微小環境の詳細な特性解析を可能にします。
しかしながら、蛍光色素を用いた蛍光標識には時間がかかり、さらに染色や剥離、イメージングを何度も繰り返す必要があります。つまり複雑で直感的に操作ができないイメージング装置は、空間プロテオミクス解析にさらなる課題をもたらす可能性があります。これに対して、Invitrogen™ EVOS™ S1000 Spatial Imaging System は、合理化された画像取得ワークフローとユーザーフレンドリーなインターフェースでこれらの課題を解決します。この使いやすい空間イメージングプラットフォームは、信頼性の高いInvitrogen™ Alexa Fluor™一次抗体および標識済みのInvitrogen™ Alexa Fluor™ Plus一次抗体、またはInvitrogen™ Aluora™試薬と併用することで、最大9つの生体分子の同時イメージングが可能であり、空間プロテオミクスイメージングのための包括的ソリューションを提供します。ここでは、EVOS S1000 Spatial Imaging Systemの空間プロテオミクスにおけるワークフローについて、サンプル前処理から画像取得、その後の正常結腸および結腸腺がん組織における免疫細胞集団の解析を含めて概説します。
方法
マルチプレックスパネルおよびシングルカラーコントロールの調製
正常ヒト結腸および結腸腺がん組織を異なるドナーから入手し、9-plexデータをEVOS S1000 Spatial Imaging Systemを用いて解析しました。それぞれの組織由来のサンプルから、以下の種類のサンプルを調製しました。
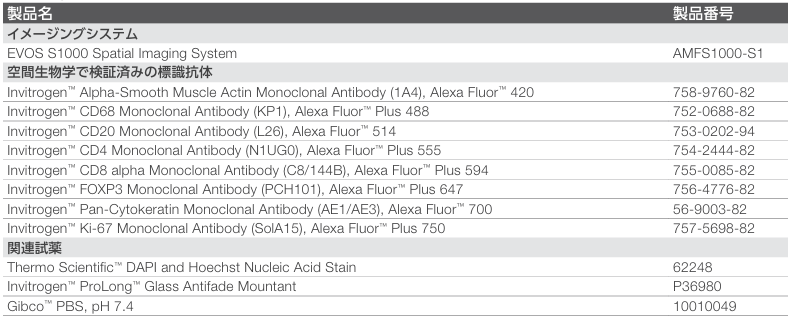
• 8種類の標識済み一次抗体(表1)と DAPIで核を染色した9-plexのサンプル
• スペクトルのアンミキシングマトリックスを構築するため、9つの色素それぞれに対応するシングルカラーコントロール(SCC)サ ン プ ル
• バックグラウンド蛍光を補正するための未染色組織サンプル
IHCと染色条件
ホルマリン固定パラフィン包埋(FFPE)組織切片は、標準的なキシレン脱パラフィン化および再水和プロトコルに供され、次いで無水シトラコン酸抗原賦活化液を用いて圧力鍋で20分間、熱誘導抗原賦活化を行いました。組織の自家蛍光を減少させる方法は、既存のプロトコルを修正したものを用いました[4]。組織サンプルをPBS中に24 mM NaOHと4.5% H2 O2の溶液を含む透明リザーバーに入れ、白色光で30分間照射しました。その後、サンプルを0.1% Triton™ X-100を含むPBS中で30分間透過処理し、3% BSAと5% NGSで室温で1時間ブロッキングしました。
一次抗体は3%BSAで希釈し、加湿器内でサンプルに加え、4 ℃で一晩インキュベートしました。DAPIによる染色は、マルチプレックスサンプルとDAPIのみのSCCに適用しました。その後、サンプルをカバースリップで覆い、Invitrogen™ ProLong™ Glass Antifade Mountantでマウントし、室温で一晩硬化させました。EVOS S1000 Spatial Imaging Systemと20倍の対物レンズを用い、0.325 µm/pixelの解像度で、全組織スキャンにより画像化し、つなぎ合わせ、スペクトルのアンミキシング処理をしました。
画像解析
細胞表現型の解析には、HALO™ ソフトウエア(バージョン 4.0.5107.318)の Highplex FL モジュール(バージョン 4.2.14)を使用しました。細胞のセグメンテーションには、DAPIを用い、核強度の最小閾値を0.01、最大値を1に設定し、全ての核を捉えました。核のセグメンテーションの積極性は、細胞の塊を分割するために高めに設定しました(0.9)。細胞の大きさを定義するため、核からの拡大半径を低い値(1)に設定しました(細胞が核より比較的大きくないため)。
膜マーカーCD68、CD20、CD4、CD8による細胞の同定は、核マーカーのKi-67とFOXP3の細胞質と核シグナルにより設定された陽性閾値に従ってスコア化されました。Ki-67と追加マーカーの二重陽性を、増殖細胞をスコア化する基準として用いました。
結果
EVOS S1000 Spatial Imaging Systemを用いたマルチプレックスイメージングのワークフロー
最大8個の標識済み一次抗体とDAPIのパネルを使うことで、1回のインキュベーションで多重染色が行えます。さらにその後すぐに、スペクトルアンミキシングによる画像検出により、組織サンプル全体におけるシングルセルレベルでのバイオマーカーの検出が可能になります(図1)。線形スペクトルを用いたアンミキシング処理のアルゴリズムは、組織サンプルの自家蛍光とSCCからの蛍光データを取り込み、カスタマイズされたアンミキシング用マトリックスを作成します。これにより、取得後の混在した蛍光スペクトルから各マーカーを分離できます(図2)。本研究では、ヒトの健常結腸と結腸腺がん組織を用いて9-plex染色と解析を行いました。
表1. Invitrogen™ブランドの標識済み抗体を用いた9-plexパネル
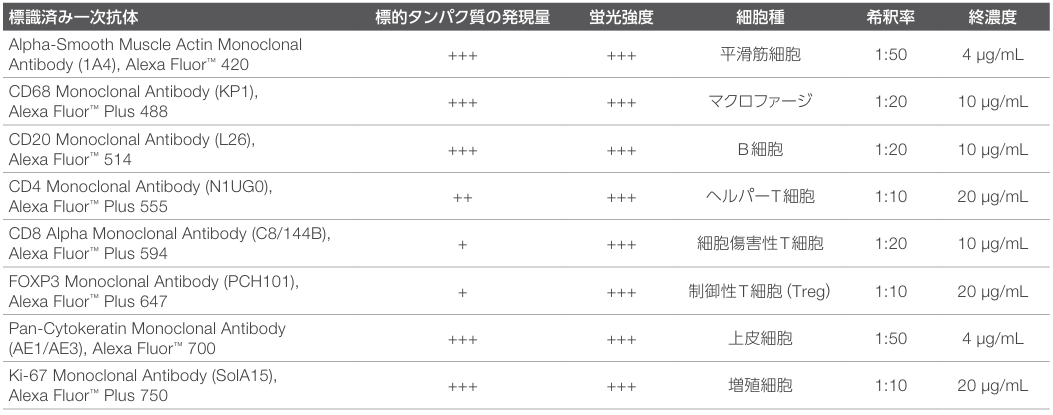
空間生物学のイメージングワークフロー
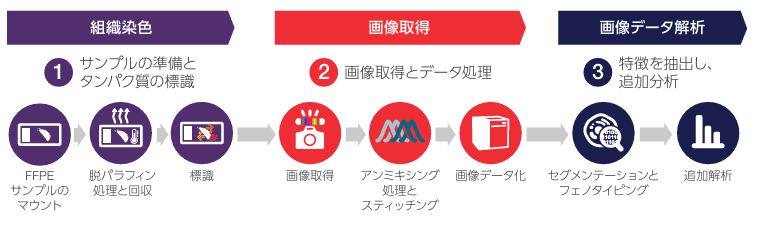
図1. 標識済み一次抗体を用いたEVOS S1000ワークフローの概要
標識済み一次抗体でパネルをデザインし、(1)最大8つのマーカーとDAPIで組織を染色し、(2)全組織をスキャン後、画像化し、スペクトルのアンミキシング処理を行う。
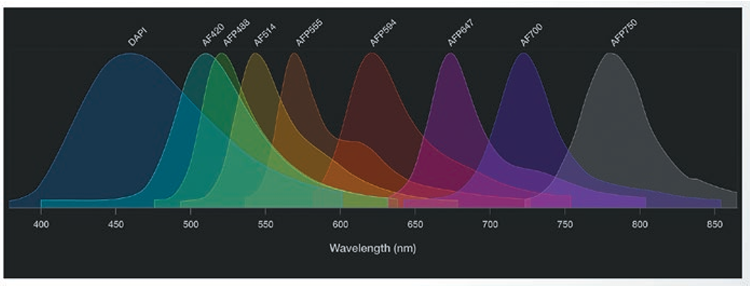
図2. 9-plexパネル内の標識済み一次抗体の蛍光スペクトル
9-plexパネルの各蛍光の相対蛍光強度を波長別にプロットしている。スペクトルは広範囲で重複しており、これを解消するにはスペクトルのアンミキシング処理が必要。
9-plexパネルを用いた結腸サンプルのイメージング
EVOS S1000 Spatial Imaging Systemを用いて、正常結腸と結腸腺がんサンプルの9-plexパネルの全組織スキャンを行いました。正常結腸サンプルのスキャン(図3A)で は 、3つの主要な構造層(緑の矢印)が確認されました。水と栄養の取り込みを担う陰窩を含む内側の粘膜層、消化された食物を腸管に沿って移動させるために粘膜を包む平滑筋の大きな帯として見られる外側の筋層、および2つの層の間にある粘膜下層は、結合組織と血管からなり、α-SMAで標識された丸い構造として確認できます。また、CD20+ B細胞とCD4+/CD8+ T細胞を含む2つの免疫細胞クラスターも確認されました(白い矢印)。結腸陰窩の拡大画像(図3B)から、マクロファージやその他の免疫細胞、Ki-67でマークされた増殖幹細胞ニッチが散在し、腸上皮を継続的に補充していることがわかります。
対照的に、結腸がんのサンプルは、腸壁の多層に浸潤した不規則で制御不能に増殖する腺窩様構造からなる腫瘍組織を有する高分化型腺がんでした(図3C)。また、マクロスケールの腫瘍の特徴である、円形のα-SMA染色構造として可視化された血管が組織全体に散在していました(白い矢印)。三次リンパ組織様構造(TLS)は腫瘍切片の左上隅にも確認されました(黄色の楕円形)。三次リンパ組織様構造は、慢性炎症組織や腫瘍組織の近くに形成される免疫細胞の密集したクラスターです[5]。組織の一部分に焦点を合わせることで、pan-cytokeratin(panCK)でマークされた浸潤した不規則な腺構造や、多数のCD68+腫瘍関連マクロファージを検出できました(図3D)。こ れ ら のデータセットは、標識済み一次抗体によるマルチプレックスイメージングと高解像度の全組織イメージングが、組織構造と腫瘍微小環境の特徴付けに威力を発揮することを示しています。
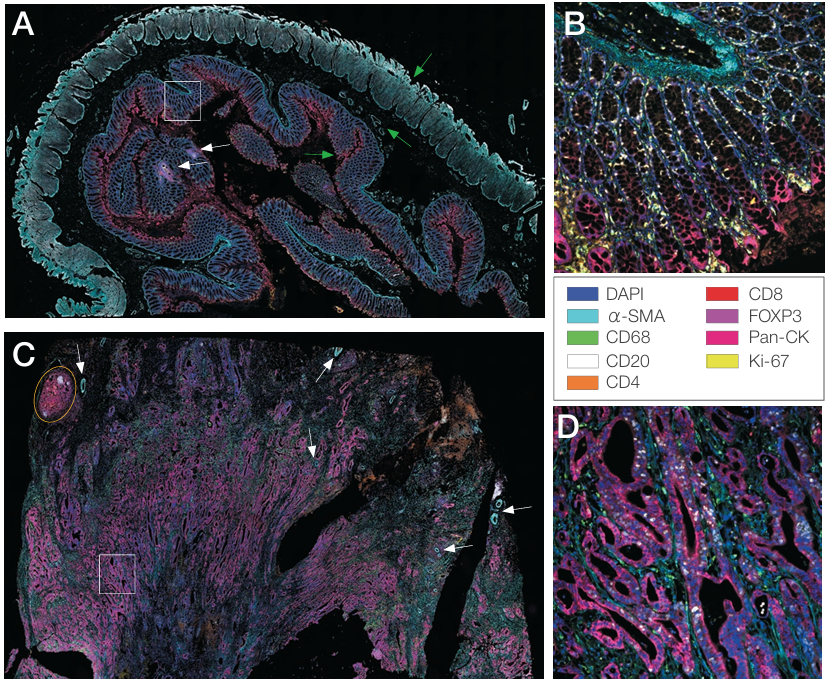
図3. 9-plex結腸パネルで染色した正常結腸および腺がん組織の画像
(A) EVOS S1000 Spatial Imaging Systemの20x対物レンズを用いて取得した正常結腸組織のアンミキシング処理を行ったイメージング画像。緑の矢印は結腸の3つの主要構造層を示します。上の矢印は外筋層、中央の矢印は粘膜下層、下の矢印は粘膜を示します。白い矢印は免疫細胞クラスターを示し、白い枠はBに示した視野の位置を示している。(B)正常結腸組織における健常陰窩構造の20倍画像。(C)結腸腺がん組織のアンミキシング処理を行った全組織スキャン画像。黄色の楕円は三次リンパ組織様構造(TLS)の位置を示し、白い矢印はα-SMAモノクローナル抗体Invitrogen™ Alexa Fluor™ 420コンジュゲートで標識した血管を示します。白い枠はDに示した視野の位置を示している。(D)腺がん組織における異常な腫瘍腺構造の20倍画像。
正常結腸と結腸腺がん組織の細胞表現型解析
細胞フェノタイピングは、組織サンプルの空間的背景の中で、シングルセルレベルで細胞タイプを同定し定量化するものであり、疾患メカニズムと治療反応を理解する上で極めて重要です。結腸の画像データの解析にはHALOソフトウエアを使用し、核の検出と細胞のセグメンテーション、各細胞の各マーカーに対する陽性・陰性の分類、細胞フェノタイピングの定義と同定という3つの主要ステップを行いました。細胞核は、DAPIチャンネルを用いて同定・分割され、続いてHALO AI Nuclei Seg V2 アルゴリズムを用いました。各マーカーの閾値調整により、細胞を正確にスコアリングすることができ、特定の細胞サブポピュレーションを同定するために、マーカーの存在に基づいて表現型を定義しました(図4)。
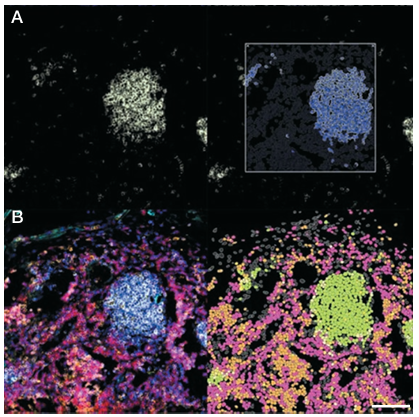
図4. HALOソフトウエアによる核セグメンテーション、マーカー閾値処理、細胞フェノタイピング
(A) 左パネル:Invitrogen™ Alexa Fluor™ 514色素でCD20モノクローナル抗体を標識した細胞の蛍光。右パネル:FOV内のウィンドウでCD20に適用された陽性シグナル閾値。(B)左パネル:マルチプレックスイメージングの画像。右パネル:検出された細胞の表現型を色分けしたもの。スケールバー:100 µm。
検出された全細胞に対する、標識済み抗体パネルを用いて同定された各免疫細胞サブタイプの割合を分析したところ、両サンプルとも、全細胞に占める免疫細胞の割合は比較的少ない(~10%)ことがわかりました(図5A)。腸管細胞、平滑筋細胞、杯細胞、その他が大部分を占めていることから、これは予想された結果です。結腸細胞の免疫細胞含有量における最大の違いは、正常組織と比較して腫瘍中のマクロファージの割合が10倍近く増加したことです。腫瘍関連マクロファージは、血管新生によって腫瘍の成長を促進することが知られており、がんに関連した炎症の主要な原因となっています[6]。また、増殖中の各細胞型の割合を調べたところ、正常組織と比較して、腫瘍では制御性FOXP3+およびCD4+ T(Treg)細胞の増殖が100倍以上増加していることが観察されました(図5B)。結腸腫瘍におけるTreg細胞の増加は、腫瘍の発生と免疫療法の失敗を促し、予後不良と関連します[7]。
図5Cの三次リンパ組織様構造(TLS)は、腺がんサンプルの全組織スキャンで同定されました。TLSは、結腸がんに対する免疫反応において重要な役割を果たし、予後の改善につながると考えられています[8,9]。腫瘍TLSの特徴を明らかにするために、プロトコル[10]を改変したものを用いて細胞組成分析を行ったところ、細胞の62%が細胞傷害性T細胞、24.5%がヘルパーT細胞、13.5%がB細胞でした。最も豊富な細胞タイプはCD8+細胞傷害性T細胞であり、これは抗腫瘍免疫反応に重要な役割を果たしています。マクロファージとTreg細胞はともにTLSの1%未満でした(図5D)。併せて、これらのデータは、EVOS S1000 Spatial Imaging Systemで収集したマルチプレックスイメージングを用いた細胞フェノタイピングと空間解析への有効性を示しています。
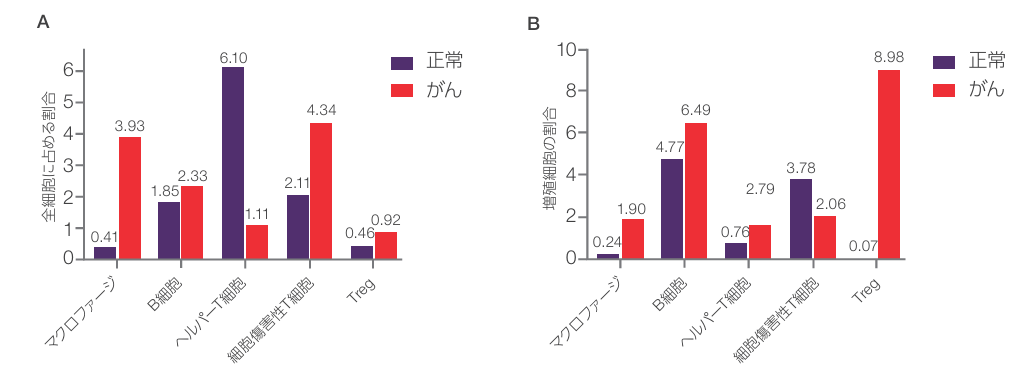
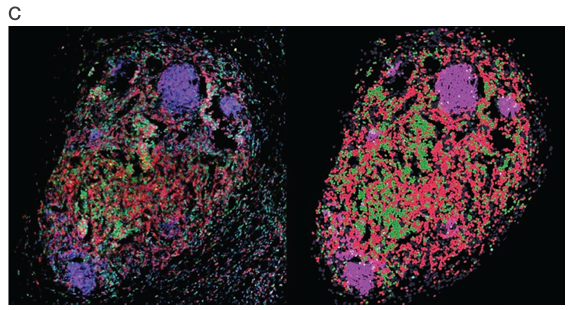
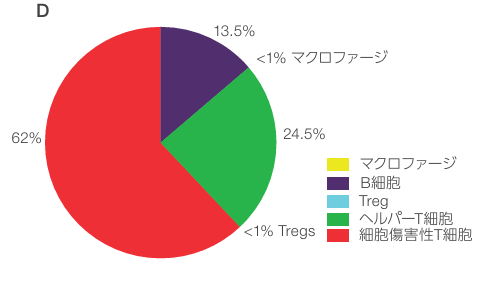
図5. 全組織と腺がん腫瘍三次リンパ組織様構造の細胞フェノタイピング
(A)正常結腸と腫瘍結腸の全組織スキャンで観察された各細胞型の割合。(B)正常結腸と腫瘍結腸の全組織スキャンで観察された各細胞タイプの増殖の割合。(C)左パネル:図3Cの黄色の楕円で輪郭を描いた結腸腺がんの三次リンパ組織様構造(TLS)の拡大画像。右のパネル:HALOソフトウエアで核のセグメンテーションと細胞表現型を行った後、TLS内で同定された細胞。マーカーはDと一致するように疑似色で表示。(D)結腸腺がんTLSの細胞構成。
結論
EVOS S1000 Spatial Imaging Systemを用いたマルチプレックスイメージングや解析技術を組み込むことで、組織構造と細胞表現型に関する詳細な知見が得られました。本研究で得られたデータは、正常結腸組織と結腸腺がん組織との間の有意な差異を浮き彫りにし、がん微小環境と免疫応答を特徴付けるためのEVOS S1000 Spatial Imaging Systemと標識済み一次抗体の有用性を明らかにしています。
参考文献
1. González NS, Salvà F, Ros J et al. (2023) Unravelling the complexity of colorectal cancer: heterogeneity, clonal evolution, and clinical implications. Cancers 15(16):4020. doi: 10.3390/ cancers15164020 2. Galon J, Costes A, Sanchez-Cabo F et al. (2006) Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 313(5795):1960–1964. doi: 10.1126/science.1129139 3. Fridman WH, Pagès F, Sautès-Fridman C, Galon J (2012) The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer 12:298–306. doi: 10.1038/nrc3245 4. Lin J-R, Izar B, Wang S et al. (2018) Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife 7:e31657. doi: 10.7554/eLife.31657 5. Wang Q, Zhong W, Shen X et al. (2024) Tertiary lymphoid structures predict survival and response to neoadjuvant therapy in locally advanced rectal cancer. npj Precis Onc 8:61. doi: 10.1038/s41698-024-00533-w
6. Chen Y, Song Y, Du W et al. (2019) Tumor-associated macrophages: an accomplice in solid tumor progression. J Biomed Sci 26:78. doi: 10.1186/s12929-019-0568-z 7. Aristin Revilla S, Kranenburg O, Coffer PJ (2022) Colorectal cancer-infiltrating regulatory T cells: functional heterogeneity, metabolic adaptation, and therapeutic targeting. Front Immunol 13:903564. doi: 10.3389/fimmu.2022.903564 8. Wang Q, Shen X, An R et al. (2022) Peritumoral tertiary lymphoid structure and tumor stroma percentage predict the prognosis of patients with non-metastatic colorectal cancer. Front Immunol 13:962056. doi: 10.3389/fimmu.2022.962056 9. Sautès-Fridman C, Petitprez F, Calderaro J et al. (2019) Tertiary lymphoid structures in the era of cancer immunotherapy. Nat Rev Cancer 19:307–325. doi: 10.1038/s41568-019-0144-6 10. Schürch CM, Bhate SS, Barlow GL et al. (2020) Coordinated cellular neighborhoods orchestrate antitumoral immunity at the colorectal cancer invasive front. Cell 182(5):1341–1359. doi: 10.1016/j.cell.2020.10.021
Ordering information